Prinzipien, Regeln und Gesetze in der Chemie
Prinzip von Le Chatelier (Prinzip vom kleinsten Zwang)

Ausübung eines Zwangs durch Änderung der Konzentration eins Produkts, was zur weiteren Bildung des Produkts führt. Darstellung aus CHEMIE 2000+ Einführungsphase, C.C. Buchner 2015

Ausübung eines Zwangs durch Änderung der Temperatur, sichtbar durch Farbänderung Bild aus CHEMIE 2000+ Einführungsphase, C.C. Buchner 2015
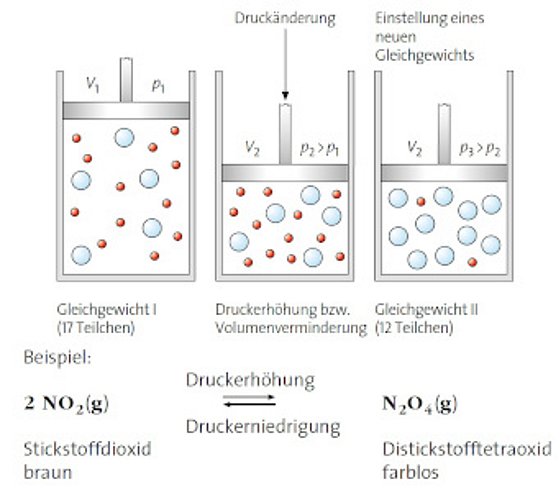
Ausübung eines Zwangs durch Änderung des Drucks, sichtbar durch Farbänderung Darstellung aus CHEMIE 2000+ Einführungsphase, C.C. Buchner 2015

Ausübung eines Zwangs durch Bestrahlung mit Licht
Nach diesem Prinzip wird die Störung eines Systems im Gleichgewicht ganz allgemein als Wirkung eines „äußeren Zwangs“ aufgefasst. Dem entgegnet das System, indem sich eine neue Gleichgewichtslage einstellt, in der die Wirkung durch den ausgeübten Zwang so klein wie möglichgehalten wird („Prinzip vom kleinsten Zwang“).
Als äußere Zwänge können auftreten:
- die Konzentrationsänderung eines Reaktionsteilnehmers (Edukt oder Produkt),
- eine Änderung der Temperatur, bei der sich das Gleichgewicht eingestellt hat,
- eine Änderung des Drucks bei Gleichgewichten an denen Gase beteiligt sind,
- eine Änderung des eingestrahlten Lichts bei Gleichgewichten an denen photoaktive Reaktionsteilnehmer beteiligt sind.
Beispiele
Prinzip vom Energieminimum und Entropiemaximum
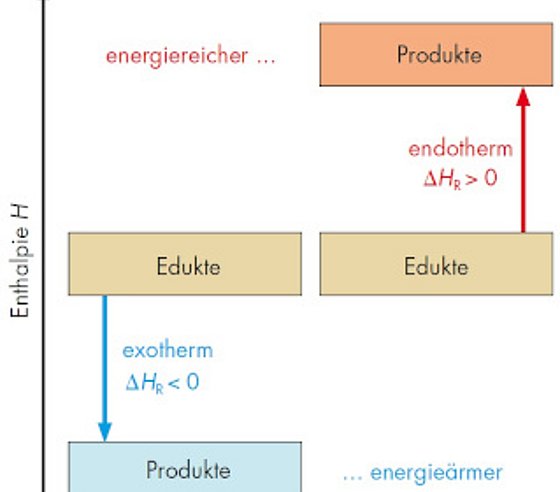
Reaktionsenergie (Reaktionsenthalpie ΔH) Darstellung aus aus CHEMIE 2000+, Sek. II (Gesamtband), C. C. Buchner 2015
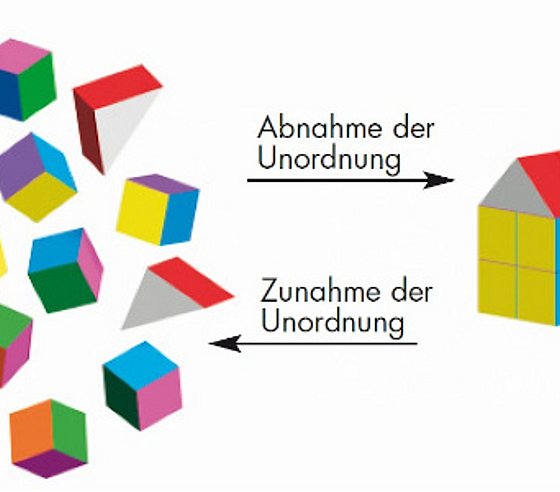
Deutung der Reaktionsentropie ΔS Darstellung aus aus CHEMIE 2000+, Sek. II (Gesamtband), C. C. Buchner 2015
➥ Nach diesem Prinzip ist jedes System bestrebt, einen Zustand mit minimaler Energie und maximaler Entropie zu erreichen.
Die freie Reaktionsenthalpie ΔGR
Die Triebkraft einer Reaktion und damit die Reaktionsrichtung ergibt sich aus dem Zusammenwirken zweier entgegengesetzter Tendenzen: 1. der Tendenz nach minimaler Enthalpie und 2. der Tendenz nach maximaler Entropie des Systems. J. W. Gibbs formulierte den Zusammenhang zwischen Enthalpie- und Entropieänderung ganz allgemein durch folgende Gleichung:
ΔG = ΔH – T · ΔS
Eine chemische Reaktion läuft dann selbsttätig ab, wenn die Änderung der freien Reaktionsenthalpie ΔGR ein negatives Vorzeichen hat: ΔGR < 0. In diesem Fall ist die Reaktion exergonisch. Ist ΔGR > 0, so spricht man von einer endergonischen Reaktion. Betrachten wir beispielsweise die Synthese von Wasser aus den Elementen und ihre Umkehrung:
2 H2(g) + O2(g) ⇄ 2 H2O(g)
ΔH0R = − 483 kJ; ΔS0R = − 0,0888 kJ · K−1
aus CHEMIE 2000+, Sek. II (Gesamtband), C. C. Buchner 2015
Donator-Akzeptor Prinzip für Elektronen- und Protonenübergänge

► Nach diesem Prinzip werden sehr viele Reaktionen, darunter die Säure-Base Reaktionen (Protolysen) und die Redoxreaktionen durch die Funktionen der Teilchen bei den Reaktionen in eine Klasse zusammengefasst oder „unter einen Hut“ gebracht.
Die nebenstehende Übersicht stammt aus CHEMIE 2000+, Qualifikationsphase, C.C.Buchner, 2015
Oktett-Regel für stabile Elektronenkonfigurationen
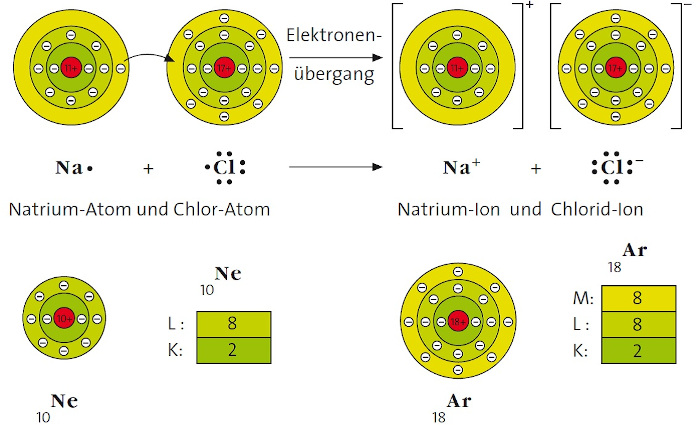
► Nach dieser Regel sind Atome bestrebt, durch Elektronenabgabe oder Elektronenaufnahme Ionen mit Edelgaskonfiguration, d.h. 8 Elektronen (Elektronenoktett) in der Valenzschale, zu erreichen.
RGT-Regel (Reaktionsgeschwindigkeits-Temperatur Regel)
► Nach dieser Regel erhöht sich die Geschwindigkeit einer Reaktion um das Doppelte bis das Vierfache, wenn die Temperatur, bei der die Reaktion abläuft, um 10°C wird.
Gesetz von den konstanten Massenverhältnissen
► Dieses Gesetz wurde aus experimentellen Befunden entwickelt. Es besagt, dass das Massenverhältnis verschiedener Stoffe bei einer Reaktion konstant ist. Das Gesetz fand seine Erklärung in der Atomhypothese und dem Atommodell von DALTON.
Gesetze von Faraday zur Elektrolyse
► Michael Faraday hat die nach ihm benannten Gesetze empirisch aus experimentellen Befunden ermittelt. Sie lassen sich unter Einbeziehung der Faraday-Konstante F in der folgenden Gleichung zusammenfassen:
Q = n(X) ∙ z ∙ F oder n(X) = Q/z ∙ F
Hier sind
n(X): Stoffmenge des abgeschiedenen Stoffes,
z: Anzahl der Elektronen, die zur Bildung eines Teilchens X übertragen werden müssen,
F: Faraday-Konstante (F = 96487 C/mol),
Q: durch den Stromkreis geflossene Ladung, Q = I ∙ t (I: Stromstärke in Ampere, t: Zeit in Sekunden)
