Art der kleinsten Teilchen in Stoffen
Von der Atomhypothese ...

John Dalton
1766 – 1844
zur Molekülhypothese

Amedeo Avogadro
1776 – 1856
Atomhypothese
Mit seiner Atomhypothese und dem nach ihm benannten Atommodell schuf Dalton 1808 die theoretische Grundlage für die konstanten Massenverhältnisse der Elemente in Verbindungen. Die kleinsten Teilchen in Elementen sind nach Dalton Atome mit einer charakteristischen Masse.
Molekülhypothese
Avogadro wertete die experimentellen Beobachtungen bei den Volumenverhältnissen, in denen Gase reagieren, aus. Das führte ihn 1811 zu der Hypothese, dass die kleinsten Teilchen in elementaren Gasen aus mindestens zwei Atomen müssen. Er nannte diese Teilchen Moleküle.
Daltons Idee – eine Antwort auf die Massenverhältnisse
Zur Erklärung der konstanten Massenverhältnisse entwickelte John Dalton zu Beginn des 19. Jahrhunderts ein Atommodell über den Aufbau der Stoffe. Er griff die Atomvorstellung des griechischen Philosophen Demokrit (um 400 v. Chr.), nach der die Stoffe aus kleinsten Teilchen, den Atomen (von atomos (griech.) = unteilbar), aufgebaut sind, wieder auf und erweiterte sie. Die Aussagen von Dalton können folgendermaßen formuliert werden:
Atommodell von Dalton (1808)
- Die chemischen Elemente sind aus kleinsten Teilchen, den Atomen aufgebaut, die bei chemischen Reaktionen ungeteilt bleiben.
- Die Atome eines Elementes haben die gleiche Masse und Größe. Atome verschiedener Elemente unterscheiden sich in ihrer Masse und Größe.
- In einer chemischen Verbindung sind die Atome der beteiligten Elemente in einem ganz bestimmten, einfachen Zahlenverhältnis gebunden.
- Bei chemischen Reaktionen werden die miteinander verbundenen Atome getrennt und in einer neuen Kombination wieder zusammengefügt.
Aus STOFF FORMEL UMWELT, Sek. I, M. W. Tausch, M. v. Wachtendonk (Hrsg.) C.C. Buchner, Bamberg 1996
Avogadros Idee – eine Antwort auf die Volumenverhältnisse
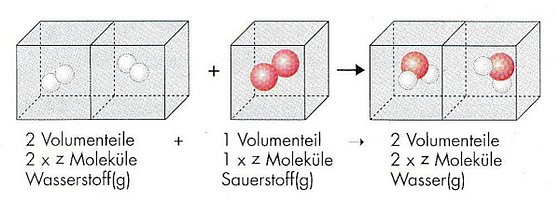
Mit dem Atommodell von Dalton lassen sich zwar die konstanten Massenverhältnisse bei chemischen Reaktionen erklären, die Volumenverhältnisse bei Gasreaktionen jedoch nicht. Wie unterscheiden sich gasförmige Stoffe in ihrem Aufbau von festen oder flüssigen Stoffen?
Zur Erklärung dieser Volumenverhältnisse stellte Avogadro die Hypothese auf, dass gleiche Volumina verschiedener Gase bei gleicher Temperatur und gleichem Druck gleich viele Teilchen des Gases enthalten. Daraus folgerte er, dass die Teilchen in elementaren Gasen nicht Atome, sondern Moleküle sein müssen. Dies widerspricht dem Dalton‘schen Modell, wonach Elemente aus Atomen bestehen. Weil Daltons Modell so erfolgreich war, wurde Avogadros Molekülhypothese Zeit seines Lebens nicht anerkannt. Sie erlangte erst beim Karlsruher Chemiekongress 1860 allgemeine Anerkennung.
