Atomorbitale in Kohlenstoff-Atomen
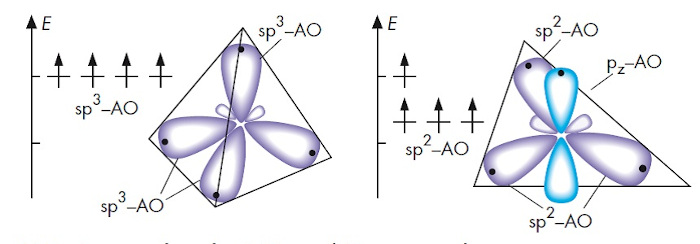
Das Orbitalmodell (Quantenmechanik und Quantenchemie) ist ein theoretisches Werkzeug, das sich besonders für Moleküle farbiger Verbindungen als sehr nützlich erweist. Mit ihm können die Bindungsverhältnisse in Molekülen mit konjugierten Doppelbindungen, also in Molekülen, die für photochemische Prozesse relevant sind, gut erklärt werden. Das Energiestufenmodell in Molekülen und die Wechselwirkung mit Licht erhalten durch das Orbitalmodell eine theoretische Grundlage. In der Chemie versteht man unter einem Orbital einen räumlichen Bereich im Atom oder im Molekül, in dem sich ein Elektron bestimmter Energie mit großer Wahrscheinlichkeit aufhält. Die Atomorbitale aus der Valenzschale des Kohlenstoff-Atoms sind verschieden, je nachdem, ob das Atom an einer Einfach-, Doppel- oder Dreifachbindung beteiligt ist. Bei Kohlenstoff-Atomen in Alkan-Molekülen sind die vier energiegleichen sp3-Hybridorbitale im Raum tetraedrisch angeordnet.
Ganz anders stellen sich die energetische Situation und die räumliche Ausrichtung bei Kohlenstoff-Atomen dar, die an Doppelbindungen beteiligt sind. Hier sind drei energiegleiche Orbitale in einer Ebene unter Winkeln von je 120° ausgerichtet. Das vierte Orbital, ein sogenanntes p-Orbital, ist etwas energiereicher und besteht aus zwei Orbitalhälften, die senkrecht oberhalb und unterhalb dieser Ebene ausgerichtet sind. Hierbei handelt es sich um ein sp2-hybridisiertes Kohlenstoff-Atom. Es ist im Orbitalmodell der Schlüssel für die Erklärung der Bindungsdelokalisation beim Benzol Molekül und bei allen anderen konjugierten Systemen.
Bindende und antibindende Molekülorbitale
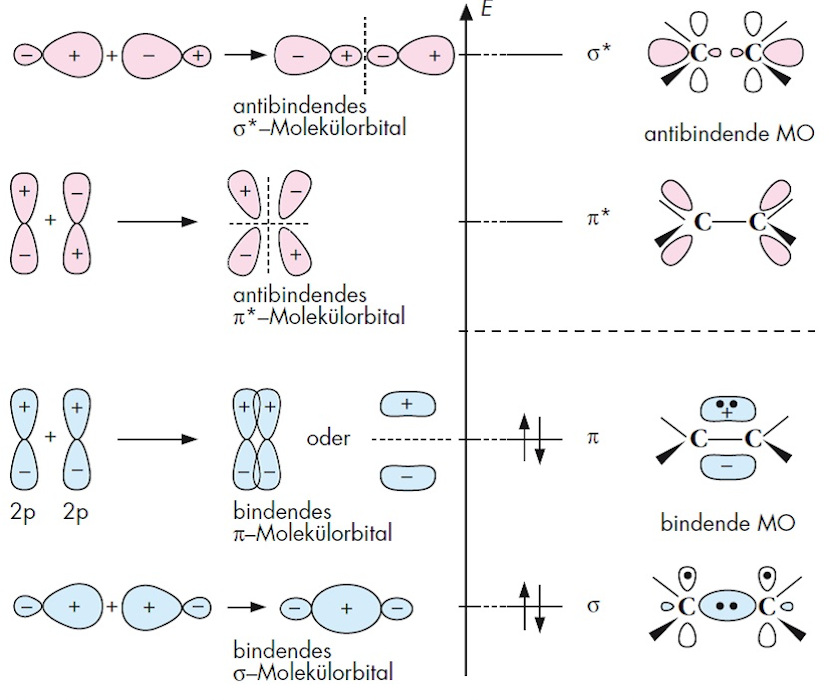
Im Orbitalmodell wird die Elektronenpaarbindung mithilfe von Mokülorbitalen MO beschrieben, die durch die Überlappung und „Verschmelzung“ von Atomorbitalen zustande kommen (B2). Die Verschmelzung kann grundsätzlich auf zwei Arten erfolgen: Bei der In-Phase Überlappung zweier Atomorbitale (gleiche Vorzeichen der überlappenden Teile in B2) entsteht ein bindendes Molekülorbital, bei dem die Aufenthaltswahrscheinlichkeit des Elektrons (man spricht auch von der Elektronendichte) zwischen den Kernen der beiden Atome erhöht wird. Dagegen führt die Außer-Phase-Überlappung jeweils zu einem antibindenden Molekülorbital, bei dem die Elektronendichte zwischen den Kernen vermindert bzw. auf null herabgesetzt wird. Ganz allgemein ist die Anzahl der gebildeten Molekülorbitale gleich mit der Anzahl der verschmolzenen Atomorbitale. Bei Kohlenstoff-Kohlenstoff Bindungen überlappen die sp3- oder sp2 Hybridorbitale zu Molekülorbitalen des σ -Typs. Diese sind rotationssymmetrisch zur Achse, die durch die beiden Kerne geht, ganz gleich, ob es sich um bindende σ- oder antibindende σ *-Molekülorbitale handelt.
Wenn nicht hybridisierte p-Atomorbitale in der in B2 angedeuteten Weise überlappen, entstehen bindende π- bzw. antibindende π* Molekülorbitale. Diese sind nicht rotationssymmetrisch, sondern antisymmetrisch zur Ebene, in der die Atome und die Substituenten einer C=C-Doppelbindung liegen. Die beiden Elektronenpaare einer C=C-Doppelbindung besetzen das bindende s- und das bindende p-Molekülorbital. Die antibindenden Molekülorbitale σ* und π* bleiben im Grundzustand unbesetzt.
Eine quantitative Verbindung zwischen Molekülen und Lichtquanten im Sinne des Orbitalmodells wird in dem Artikel 1 mol Quanten? Ja bitte, aber blaue! erläutert.
